Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.78 n.2 México Dec. 2007
Ecología
Macromicetos del Parque Educativo Laguna Bélgica, municipio de Ocozocoautla de Espinosa, Chiapas, México
Macrofungi from Parque Educativo Laguna Bélgica, Municipality of Ocozocoautla de Espinosa, Chiapas, Mexico
Freddy Chanona–Gómez1, René H. Andrade–Gallegos1 *, Jorge Castellanos–Albores2 y José E. Sánchez1
1 El Colegio de la Frontera Sur (ECOSUR), Km 2.5 Carretera antiguo aereopuerto, Tapachula, Chiapas, México.
2 El Colegio de la Frontera Sur (ECOSUR), Barrio Ma. Auxiliadora, San Cristóbal de las Casas, Chiapas, México.
* Correspondencia:
randrade@ecosur.mx
Recibido: 22 marzo 2006
Aceptado: 13 marzo 2007
Resumen
El presente estudio tuvo como objetivos contribuir al conocimiento de los macromicetos que crecen en el Parque Educativo Laguna Bélgica (PELB), en Ocozocoautla de Espinosa, Chiapas y determinar el índice de diversidad de Simpson y similitud de Sorensen de la micobiota existente en los diferentes tipos de vegetación. Se realizaron 24 exploraciones micológicas durante un año, encontrándose 144 especies (24 Ascomycota y 120 Basidiomycota). El índice de diversidad, mostró que la vegetación con la micobiota más diversa fue la del bosque de Quercus elliptica (D= 0.9678) la cual presentó mayor similitud con el bosque de Liquidambar stracyflua (Is= 83 %). El sustrato más frecuente fue la madera en descomposición (57.63 %). Se determinaron las especies de macromicetos potencialmente utilizables para el consumo humano (22 especies), lo que determinó el valor micológico del área de estudio en 15.27 %. Del total de especies determinadas 22 son nuevos registros para el estado de Chiapas; 4 Ascomicetos Scutellinia scutellata, Xylaria amphitele, X. persicaria, Chlorociboria aeruginosa, y 18 Basidiomicetos Amanita pantherina, Geastrum striatum, Hydnum repandum, Hygrocybe miniata, Scleroderma verrucosum, Cotylidia diaphana, Lactarius indigo, Phlogiotis helvelloides, Hydnochaete olivaceae, Phellinus ferruginosus, P. contiguus, P.rufitinctus, Thelephora terrestris, T. cervicornis, Perenniporia ohiensis, Diplomitoporus lenis, Schizopora paradoxa y Tremella fuciformis.
Palabras clave: hongos silvestres, bosque de Quercus, bosque de Liquidambar, matorral herbáceo, diversidad fúngica.
Abstract
The objectives of this study were to contribute to the knowledge of macro fungi growing in the "Parque Educativo Laguna Belgica" (PELB), in Chiapas, Mexico and to determine the diversity and similarity indexes for its mycobiota in each type of vegetation. Twenty four mycological explorations were made during a year, resulting in the identification of 144 species (24 Ascomycota and 120 Basidiomycota). The diversity of fungal species was determined through the index of Simpson and the similarity among the existing mycobiota inside the different types of vegetation was determined by means of the index of Sorensen. The index of diversity pointed out that the vegetation with the most diverse mycobiota was Quercus elliptica forest (D= 0.9678) which presented greater similarity than the forest of Liquidambar styraciflua (Is= 83%). Rot wood was found to be the most frequently used substratum for the macromycetes (57.63%). Twenty two species of potential use for human consumption were found, determining a mycological value of 15.27 % for the area. Twenty two species were considered as new records for the state of Chiapas; 4 Ascomycetes Scutellinia scutellata, Xylaria amphitele, Chlorociboria aeruginosa, X. persicaria and 18 Basidiomycetes (Amanita pantherina, Geastrum striatum, Hydnum repandum, Hygrocybe miniata, Scleroderma verrucosum, Cotylidia diaphana, Lactarius indigo, Phlogiotis helvelloides, Hydnochaete olivaceae, Phellinus ferruginosus, P. contiguus, P.rufitinctus, Thelephora terrestris, T. cervicornis, Perenniporia ohiensis, Diplomitoporus lenis, Schizopora paradoxa and Tremella fuciformis.
Key words: wild fungi, Quercus forest, Liquidambar forest, herbaceus brushwood, Macromycetes, fungal diversity.
Introducción
México, considerado como uno de los países con mayor biodiversidad en el planeta (Toledo, 1988), posee alrededor de 30 tipos de vegetación y alrededor de 22 000 especies de plantas vasculares (Rzedowski, 1981, 1991). Tradicionalmente, los estudios de diversidad consideran los reinos superiores (plantas y animales) e ignoran los microorganismos (bacterias, protozoarios y hongos), por lo que una gran parte de sus representantes aún se desconocen a pesar de la importancia de su desempeño en la naturaleza (Guzmán, 1994; Herrera, 1994).
De los hongos, se ha calculado que sólo se conoce el 4 % del total de especies que supuestamente existen en el mundo (Hawksworth, 1991). Guzmán (1994 y 1998) estimó para México entre 120 000 y 140 000 especies, con base en la diversidad de plantas vasculares que prosperan, de las que únicamente se conocen 6 300; es decir, el 4.5%. Para el estado de Chiapas, en el sureste del país, se estiman 20 000 especies de hongos; sin embargo, se han registrado sólo 441. Esto corresponde probablemente al 2.2 % de la micobiota de Chiapas. La gran mayoría de los trabajos que han abordado los hongos del estado de Chiapas han sido esporádicos, y si bien se ha logrado explorar 6 de las 9 regiones socioeconómicas en las que se divide la entidad, en algunas de ellas los sitios de recolecta han sido muy puntuales y no son representativos de las mismas. Las regiones que tienen más registros son las que corresponden a la selva lacandona, la planicie costera del Soconusco y los Altos de Chiapas (Andrade y Sánchez, 2005).
El Parque Educativo Laguna Bélgica (PELB) se encuentra en el límite suroeste de las montañas del norte y noroeste de la depresión central del estado (Müllerried, 1957); es un área adyacente a la Reserva de la Biosfera Selva El Ocote que cuenta con una gran riqueza fúngica poco estudiada y no utilizada por las comunidades aledañas. De esta zona únicamente se tiene el registro de Cifuentes y Guzmán (1981), donde mencionan 10 especies no conocidas previamente en México, de las cuales 4 procedían del PELB; 2 de ellas, Tricholoma cystidiosa y Lepiota pseudorubiginosa, resultaron nuevas para la ciencia; las otras 2, nuevas para el país, son Pluteus riberaltensis Singer var. missionensis Singer, únicamente conocida de Argentina, y Lepiota roseola Beeli ( mencionada de Los Tuxtlas, Veracruz y del PELB) que sólo se conocía del continente africano.,
Materiales y métodos
Sitio de estudio. El Parque Educativo Laguna Bélgica se ubica en el municipio de Ocozocoautla de Espinosa, Chiapas, México (Fig. 1), entre los 93° 27' 09" y 93° 27' 32" O y los 16° 52' 36" y 16° 53' 09" N (Escobar, 2003). Su extensión es de 47.5 hectáreas. El clima es cálido húmedo con lluvias en verano, 1000 a 1200 mm de lluvia anual y temperatura media de 22° C (Sánchez, 1996). Su vegetación corresponde a bosque tropical subperennifolio, con elementos de bosque tropical perennifolio y mesófilo de montaña (Sánchez, 1996). Escobar (2003) diferenció las asociaciones vegetales de Quercus elliptica, acahual arbóreo, pastizal y asociación secundaria de herbáceas, para las diferentes zonas del parque educativo. Para el presente trabajo se utilizó la Clasificación de Escobar (2003) y las observaciones previas al trabajo, para el que se eligieron el bosque de Q. elliptica, el matorral herbáceo, la selva mediana y un fragmento de bosque de Liquidambar stracyflua el cual está asociado con el bosque de Quercus, que en suma contienen una amplia gama de especies arbóreas características (Escobar, 2003).
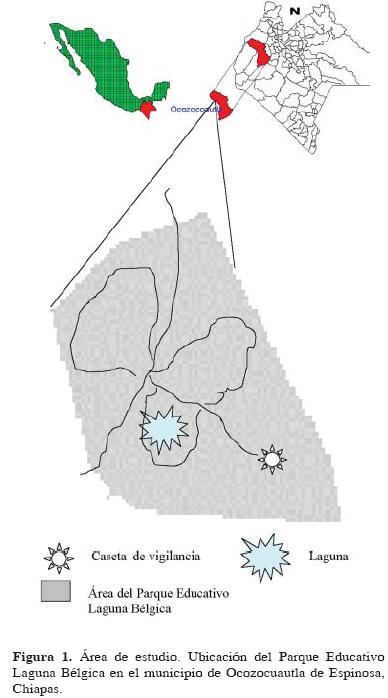
Métodos. Se realizaron exploraciones cada 15 días con la finalidad de conocer y determinar la composición de las diferentes comunidades micológicas existentes al interior de cada tipo de vegetación en el lapso de un año. Los muestreos se realizaron mediante caminatas en puntos aleatorios, recorriendo toda el área que conforma la vegetación en estudio del PELB. Cada muestreo se realizó durante 2 días consecutivos por un periodo de 6 horas diarias (7 am a 1 pm). Para las recolectas y toma de datos de dichos ejemplares se emplearon las técnicas propuestas por Guzmán (1977), en los diferentes substratos (e.g. tierra, madera en descomposición, mantillo del bosque). Los ejemplares fueron trasladados al laboratorio de micología de El Colegio de la Frontera Sur para su determinación y postriormente quedar depositados en la colección micológica de la institución.
Los ejemplares se identificaron mediante un análisis de las características macro y microscópicas basadas en el concepto de morfoespecie. Para la microscopía se realizaron cortes del cuerpo fructífero; las preparaciones se montaron con KOH al 5 %, reactivo de Melzer y rojo congo. La identificación se efectuó mediante las claves de Guzmán y Herrera (1969), Charles (1974), Guzmán (1977), Moser (1978), Gilbertson (1979), Chacón y Guzmán (1983), Hurley (1983), Cifuentes et al. (1984), Guzmán (1985), Gilbertson y Ryvarden (1986, 1987), Villegas y Cifuentes (1988), Larsen y Cobbg (1990), Díaz Barriga (1992), Sierra (1992), Ryvarden y Gilbertson (1993), Chacón et al. (1995), Sánchez Jácome y Guzmán Dávalos (1997) y San Martín et al. (1998).
Análisis del índice de diversidad e interpretación de los resultados. Para analizar la riqueza, diversidad y distribución de las especies fúngicas por tipo de vegetación, se elaboró una matriz de presencia–ausencia, con la finalidad de poder obtener el índice de Simpson (Magurran, 1989; Kikvidze, 2000), definido como: 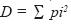
Para calcular la similitud en la composición de especies fúngicas entre los diferentes tipos de vegetación estudiados, se utilizó el índice de similitud de Sorensen (Is) Sánchez y López (1988), basado en el número de especies totales y especies comunes entre 2 paisajes: Is= 2 S / (N1 + N2)
Resultados
Durante un año se recolectaron 1230 ejemplares de macromicetos procedentes del PELB y se determinaron 144 especies , de las cuales 24 (16.66 %) pertenecen a la división Ascomycota y 120 (83.34 %) a Basidiomycota (Apéndice 1). Al estado de Chiapas corresponden 22 nuevos registros; 4 son Ascomycetes: Scutellinia scutellata, Xylaria amphitele, X. persicaria, Chlorociboria aeruginosa, y 18 Basidiomycetes: Amanita pantherina, Geastrum striatum, Hydnum repandum, Hygrocybe miniata, Scleroderma verrucosum, Cotylidia diaphana, Lactarius indigo, Phlogiotis helvelloides, Hydnochaete olivacea, Phellinus ferruginosus, P. contiguus, P. rufitinctus, Thelephora terrestris, T. cervicornis, Perenniporia ohiensis, Diplomitoporus lenis, Schizopora paradoxa y Tremella fuciformis.
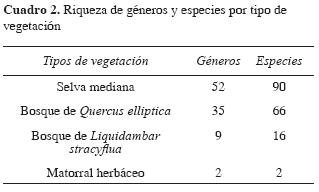
Al analizar los diferentes tipos de vegetación, la selva mediana resultó ser la zona más favorecida por la riqueza de especies de macromicetos (90 especies, 62.5 %), bosque de Q. elliptica (66 especies; 46.83 %), bosque de L. stracyflua (16 especies; 11.11 %) y el matorral herbáceo solamente con 2 especies (1.39 %).
En la selva mediana se encontraron 52 géneros con 90 especies. Los géneros con el mayor número de especies son: Xylaria (8), Phellinus (8), Polyporus (6), Stereum (5), Marasmius (5), Ramaria (4), Auricularia y Cookeina (3). En tanto que Camillea y Scleroderma sólo presentaron 2 especies, y Earliella, Fomes, Ganoderma, Geastrum, Pycnoporus, Rigidoporus y Trichaptum solamente tuvieron una representante. Las especies de hongos que predominaron en esta vegetación son: Cookeina sulcipes, C. venezuelae, Chondrostereum sp., Stereum ostrea, Schizopora paradoxa, Pycnoporus sanguineus y Gloeporus dichrous.
Pycnoporus sanguineus y Schizophyllum commune se hallaron creciendo dentro del área del PELB; son especies utilizadas como indicadoras de disturbio (Díaz Barriga et al, 1988) dentro de las zonas de vegetación en estudio. Auricularia auricula, A. mesenterica, Cookeina sulcipes, C. tricholoma, Phillipsia dominguensis, Ganoderma applanatum, Rigidoporus ulmarius, Hexagonia papyracea, Panus crinitus, P. rudis, Polyporus sp. y Trichaptum sector son típicas de zonas tropicales (Guzmán Dávalos y Guzmán, 1979; Guzmán Dávalos, 1986, citado por Chacón y Medel, 1993).
En el bosque de Q. elliptica se identificaron 35 géneros y 66 especies, determinándose como predominantes por el número de especies los géneros Russula (10), Xylaria (7), Ramaria (6) y Amanita (5), mientras que Marasmius, Scleroderma, Geastrum e Hypoxylon presentaron 2 especies cada uno y Boletus, Ganoderma, Strobilomyces y Tylopilus, una sola. Las especies de macromicetos predominantes para esta vegetación son: Geastrum quadrifi dium, Clavaria sp., Ramaria sp. F, Scleroderma verrucosum, Ramaria sp. B, Ramaria stricta, Russula aff. americana.
Respecto al bosque de L. stracyflua se determinaron 9 géneros y 16 especies. Predominan los géneros Russula con 5 especies, Ramaria, Laccaria y Xylaria con 2. Los macromicetos más comunes en el bosque de L. stracyflua son: Collybia sp., Ramaria sp. C, Ramaria stricta, Russula sp. D y Xylaria longipes.
En el matorral herbáceo solamente se recolectaron Laetiporus sulphureus y Pycnoporus sanguineus, Guzmán Dávalos y Guzmán (1979) argumentan que por la escasa vegetación y humedad del suelo, la diversidad fúngica de los zacatonales y matorrales tiende a ser poca.
El índice de Simpson (Cuadro 1) señala que el bosque de Q. elliptica (D= 0.9678) y la selva mediana (D= 0.9555) poseen una mayor diversidad con respecto a L. stracyflua (D= 0.7026) y el matorral herbáceo (D= 0.1424).

De acuerdo con el número de especies compartidas de macromicetos se obtuvo el índice de similitud de Sorensen (Sánchez y López, 1988). La selva mediana presentó mayor similitud con el bosque de Q. elliptica (Is= 52 %) y en menor grado con el matorral herbáceo (Is= 10 %), mientras que el bosque de L. stracyflua presentó una mayor afinidad con Quercus elliptica (Is= 83 %) y no presentó similitud con el matorral herbáceo.
Discusión
El análisis de los resultados revela que la selva mediana contiene la mayor riqueza (Cuadro 2), lo que probablemente se debe al abundante material orgánico en descomposición (madera, hojas, ramas, etc) que de forma cualitativa se observó en el suelo forestal. La información obtenida de los guardias del PELB (com. pers.) reveló que el área tuvo una gran influencia humana (antropocéntrica) en el pasado, ya que hace 3 décadas fue utilizada para cultivos de café (Coffea arabica), por lo que se considera zona perturbada (acahual) en estado de regeneración.
Para la superficie del PELB (47.5 ha) la cantidad de especies obtenidas es elevada (144), si se toma en cuenta que sólo representa el 0.0006 % del territorio estatal. Lo anterior fue evidenciado en el registro de Cifuentes y Guzmán (1981) al describir 2 especies y 2 registros nuevos de material proveniente del área de estudio.
Al analizar la micobiota de los 4 tipos de vegetación, se observa que, si bien, la selva mediana posee un mayor número de especies con respecto al bosque de Q. elliptica, el índice de diversidad es ligeramente menor, lo que hace suponer que la micobiota de la selva mediana es más compleja en su estructura y funcionamiento. Por otro lado, con base en los valores del índice de similitud podemos aseverar que cada tipo de vegetación del PELB convive con una micobiota característica y muy particular al compartir pocas especies.
Con base en el índice de Hawksworth, que se ha utilizado para extrapolar la diversidad fúngica de un área con base en la diversidad de las plantas vasculares (existe una relación de 6:1 entre el número de especies de hongos con respecto al número de plantas vasculares; Guzmán, 1994; Hawksworth, 1991), se espera que el PELB posea alrededor de 1482 especies de hongos, puesto que dicha área contiene alrededor de 247 especies de plantas vasculares (Escobar, 2003). A pesar de su probable alta diversidad, es un lugar poco explorado en cuanto a la sistemática y taxonomía de los hongos.
Cifuentes et al. (1993) mencionan resultados similares para el parque ecológico Omiltemi en el estado de Guerrero, donde registraron 205 especies en 4 tipos de vegetación bien diferenciados, después de 2 años de muestreo. Por otra parte, Cifuentes et al. (1997), después de varios años de recolectas en 6 localidades ubicadas en el eje neovolcánico de México, registraron un total de 469 especies, aunque estimaron haber recolectado cerca de 1600; y tomando en consideración las especies identificadas, cada región contaba entre 69 y 152 especies de hongos macroscópicos.
Los anteriores resultados refuerzan la hipótesis de que en el PELB aún es posible encontrar más especies y sumarse a la cantidad registrada en este estudio (144). Tal vez para ello, en primer lugar, sería necesario recolectar por más de un año, pues la fenología de algunas especies requiere periodos mayores, y en segundo lugar, abarcar una mayor superficie de muestreo.
Entre los géneros de hongos ectomicorrizicos se tienen los siguientes: Russula con 16 especies, Amanita con 4, Scleroderma y Boletellus con 3, Geastrum, Laccaria y Panus con 2 cada uno. Garza et al. (1985) consideran de gran importancia a muchas especies de éstos géneros al mantener una estrecha relación con el bosque y su mantenimiento (productividad). Las ectomicorrizas de Russula, Lactarius y Amanita son capaces de utilizar la celulosa y otros polímeros vegetales. Generalmente las ectomicorrizas se encuentran asociadas a árboles de hojas anchas (Deacon, 1993), tales como roble, haya, pino, abeto.
De los hongos del PELB con este tipo de micorrizas , 23 especies (71.87 %) se encuentran asociadas al bosque de Q. elliptica. En la selva mediana se encontraron Scleroderma verrucosum, Scleroderma sp. A , lo que representa el 6.25 %. No se recolectaron hongos ectomicorrícicos en el matorral herbáceo. El bosque de L. stracyflua presentó 11 especies (34.37 %).
Janos (1983) menciona que en la selva mediana de algunas regiones del país escasean los árboles que son susceptibles de ectomicorrizarse, pues solamente crecen árboles tropicales que forman micorrizas del tipo vesículo–arbusculares. Esto da por resultado la predominancia de hongos lignícolas (Díaz Barriga et al., 1988); sin embargo, Guzmán (1983; citado por Díaz Barriga et al., 1988) registra ectomicorrizas para una vegetación del trópico lluvioso en el estado de Quintana Roo, lo que hace suponer que sí se puede dar la existencia de ectomicorrizas en estos biomas.
En cuanto al hábitat de los macromicetos del PELB, 8 especies se encontraron en la hojarasca (5.55 %). Entre las especies que corresponden al bosque de L. stracyflua se tiene a Laccaria laccata y Marasmius sp A, lo que representa el 1.38 % del total de las especies. En el bosque de Q, elliptica se hallaron 6 especies (4.16 %), Panaeolus sp., Marasmius sp. A y B, Thelephora terrestris, Xylaria amphitele y Ramaria sp. F, y 2 (1.38 %) en la selva mediana, Marasmius sp. B y Collybia sp.
Las especies humícolas fueron 13 (9.02 %). En el bosque de L. stracyflu, únicamente Collybia sp. (0.69 %). Para el bosque de Q. elliptica las especies halladas fueron Marasmius sp. A y B, Ramaria sp., Geastrum quadrifi dium, G. striatum, Ramaria sp. D y Clavaria sp., lo que representa el 4.86 % del total. En la selva mediana se localizó Ramaria sp. F, Agaricus campestris, Ramaria sp. B, Armillariella sp. y Scleroderma sp. A (3.47 %).
Las 83 especies lignícolas,(57.63 %) se hallaron distribuidas de la siguiente manera: bosque de L. stracyflua 2 especies (1.38 %); bosque de Q. elliptica 15 (10.41 %), matorral herbáceo 2 (1.38 %) y selva mediana 71 (49.30 %). Cabe señalar que algunas especies, como Hypoxylon thouarsianum, Xylaria longipes, Xylaria sp. E, Ramaria sp. C, Inonotus tomentosus, Trametes sp. comparten 2 o más tipos de vegetación. Heredia (1989) y Díaz Barriga et al. (1988) mencionan que Panus crinitus tanto crece en el bosque de encino como en el de encino–pino, lo que indica que es una especie cosmopolita, por lo que se esperaba encontrar en los diferentes tipos de vegetación. Sin embargo, en este caso se observó que sólo habitaba la selva mediana.
Al realizarse las observaciones ambientales se pudo determinar de forma cualitativa que en el bosque de Quercus y en el de Liquidambar la cantidad de madera en descomposición era menor en comparación con la selva mediana, de lo que se deduce que el número de especies lignícolas también fue menor, ya que el clima y la humedad favorecen la rápida descomposición de la materia orgánica (Guzmán–Dávalos y Guzmán, 1979).
Deacon (1993) menciona que algunos estudios han demostrado que la madera de varios árboles caducifolios (maderas duras) producen compuestos que estimulan el crecimiento de los hongos, mientras que otras producen compuestos fenólicos inhibidores del crecimiento de algunas especies, por lo que la descomposición de la madera tiende a ser ocasionada por hongos altamente especializados.
Los hongos lignícolas o degradadores de madera se distribuyeron principalmente en la selva mediana, siendo representativos los géneros Xylaria con 10 especies, Phellinus con 9, Polyporus con 6 y Stereum con 4. Los géneros Auricularia y Cookeina contribuyeron con 3, Camillea con 2 y Antrodiella, Cotylidia, Cyathus, Cymatoderma, Phillipsia, Ramaria y Scutellinia con 1 especie cada uno (Apéndice 1).
Camillea se encuentra comúnmente en lugares expuestos al sol (sitios claros naturales o troncos muertos y substratos atacados por termitas). Hypoxylon prefiere sitios más secos (patógeno oportunista) (Lodge, 1993); algunas de sus especies, como H. thouarsianum, se consideradan pioneras o colonizadoras del suelo o atacando árboles (Whalley,1993). El género Xylaria ocupa lugares inaccesibles con densa vegetación y ciertas condiciones de humedad, mientras que las especies de Kretzschmaria rara vez se encuentran en esas condiciones; comúnmente son hongos asociados con troncos o madera, o bien, pueden ser fitopatógenos o parásitos benignos (Lodge, 1991).
Algunas especies, tales como Cordyceps sp. y Xylaria persicaria viven en relación con insectos (escarabajos) y semillas de Quercus elliptica, respectivamente.
Las familias mejor representadas y que sumadas representan el 57.6% son: Xylariaceae (16 especies); Coriolaceae (15 especies); Russulaceae (15 especies); Hymenochaetaceae (12 especies); Tricholomataceae (11 especies); Ramariaceae y Polyporaceae (7 especies cada una) (Fig. 2).

Entre las especies comestibles (22 especies, 15.27 %) en la zona de estudio se encuentran Auricularia auricula, A. cornea, A. mesenterica, Cookeina sulcipes, C. tricholoma, C. venezuelae, Laccaria laccata, L. amethystina, Hydnum repandum, Lactarius indigo, Schizophyllum commune, Strobilomyces fl occopus, Pleurotus djamor, Panus crinitus, Agaricus silvaticus, A. campestris, Russula olivacea, Phlogiotis helvelloides, Suillus tomentosus, Cantharellus cibarius, Laetiporus sulphureus, Calvatia gigantea. Las especies anteriormente mencionadas podrían constituir una alternativa alimentaria para los habitantes de las zonas aledañas (Ocuilapa y Nuevo San Juan Chamula), para lo cual sería importante desarrollar estudios de abundancia, distribución, fenología, etc. Los hongos comestibles se distribuyeron en los 4 tipos de vegetación: la selva mediana presentó 9 especies, los bosques de Quercus elliptica y Liquidambar stracyflua 3 especies cada uno y el matorral herbáceo una especie. Las diferencias señaladas anteriormente pueden deberse a la estructura de la vegetación arbórea y herbácea (número de especies, cobertura, frecuencia de las especies dominantes), efecto de borde, procesos de regeneración y disturbio de la zona, entre otros procesos.
Con respecto a los hongos venenosos (2.08 %), se determinaron Amanita pantherina y A. verna, las cuales son consideradas como especies que causan micetismo grave debido a su alta toxicidad (Garza et al., 1985; Díaz Barriga et al., 1988), y Scleroderma verrucosum que sólo causa trastornos intestinales menores (diarreas). Las especies comestibles fueron más abundantes en cuanto al número de especies, en relación con los hongos venenosos (7.3:1).
El número de especies determinadas al final del presente trabajo ascendió a 144 de las cuales el 15.27 % se consideran potencialmente comestibles, aunque su recolecta no está permitida por ser un área protegida. Es importante recalcar que en las comunidades aledañas sólo se consumen 2 especies (Cantharellus cibarius y Pleurotus djamor) que casualmente se encuentran en la zona del PELB y se extraen de su medio natural de manera esporádica e ilegal en pequeñas cantidades. En Ocuilapa y Nuevo San Juan Chamula se observó que el consumo de hongos se enfoca más a los industrializados (champiñones) y en menor escala a los silvestres, debido probablemente a la pérdida del conocimiento tradicional en ambas comunidades zoques.
Agradecimientos
Este estudio fue posible gracias al apoyo económico de CONACYT por haber proporcionado al primer autor la beca para obtener el grado de maestro en ciencias en Recursos Naturales y Desarrollo Rural en El Colegio de la Frontera Sur, Tapachula, Chiapas.
Literatura citada
Andrade Gallegos R. H. y J. E. Sánchez Vázquez. 2005. La diversidad de hongos en Chiapas: un reto pendiente. In Diversidad biológica en Chiapas, M. González Espinosa, N. Ramírez–Marcial y L. Ruiz–Montoya (eds.). El Colegio de la Frontera Sur, Consejo de Ciencia y Tecnología del Estado de Chiapas (COCYTECH) y Plaza y Valdés, México, D.F. p. 33–80. [ Links ]
Chacón, S., G. Guzmán, L. Montoya y V. M. Bandala. 1995. Guía ilustrada de los hongos del Jardín Botánico Francisco Javier Clavijero de Xalapa, Veracruz y áreas circunvecinas. Instituto de Ecología, Xalapa, Veracruz. 142 p. [ Links ]
Chacón, S. y G. Guzmán. 1983. Ascomycetes poco conocidos en México. Boletín de la Sociedad Mexicana de Micología 18:183–218 [ Links ]
Chacón, S. y R. Medel. 1993. Los hongos (principalmente macromicetos) registrados en el bosque mesófilo de montaña de México. Reporte Científico, Núm. Especial 13 . Facultad de Ciencias Forestales, Universidad Autónoma de Nuevo León, Linares. p. 61–110. [ Links ]
Charles, K. 1974. Introduction to mushroom hunting. Dover, New York. 59 p. [ Links ]
Cifuentes Blanco, J., M. Villegas Ríos y L. Pérez Ramírez. 1984. Claves para determinar microscópicamente género de macromicetos. Herbario de la Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F. 29 p. [ Links ]
Cifuentes Blanco, J., M. Villegas Ríos y L. Pérez Ramírez. 1993. Hongos macroscópicos. In Historia Natural del Parque Ecológico Estatal Omiltemi, Chilpancingo, Guerrero, México, I. Luna Vega, y J. Llorente Bousquets (eds.). CONABIO y Universidad Nacional Autónoma de México, México, D.F. p. 59–126. [ Links ]
Cifuentes Blanco, J., M. Villegas Ríos, J. L. Villaruel–Ordaz y S. Sierra Galván. 1997. Diversity of macromycetes in pine–oak forest in the Neovolcanic axis, México. In Mycology in sustainable development: expanding concepts, vanishing borders, M.E. Palm e I. H. Chapela (eds.). Parkway, Boone, North Carolina. p. 111–121. [ Links ]
Cifuentes, J., y G. Guzmán. 1981. Descripción de hongos tropicales (Agaricales) no conocidos previamente en México. Boletín de la Sociedad Mexicana de Micología 16:35–61. [ Links ]
Deacon, J. W. 1993. Introducción a la micología moderna. Limusa, México, D.F. 350 p. [ Links ]
Díaz Barriga, H., F. Guevara y R. Valenzuela. 1988. Contribución al conocimiento de los macromicetos del estado de Michoacán. Acta Botanica Mexicana 2:21–44 [ Links ]
Díaz Barriga, H. 1992. Hongos comestibles y venenosos de la cuenca del lago de Pátzcuaro Michoacán. Centro de Investigación y Desarrollo del Estado de Michoacán. 87 p. [ Links ]
Escobar, M. C. 2003. Caracterización de la vegetación del Parque Educativo Laguna Bélgica, Chiapas. Tesis, Universidad de Ciencias y Artes de Chiapas, Tuxtla Gutiérrez. 108 p. [ Links ]
Garza, F., J. Castillo y J. García. 1985. Macromicetos asociados al bosque de Quercus rysophylla en algunas localidades del estado de Nuevo León. Revista Mexicana de Micología 1: 423–437 [ Links ]
Gilbertson, R. L. 1979. The genus Phellinus (Aphyllophorales: Hymenochaetaceae) in Western North America. Mycotaxon 9:51–89 [ Links ]
Gilbertson, R. L. y L. Ryvarden. 1986. North American polyporus, vol. I. Fungiflora, Oslo. p. 1–437. [ Links ]
Gilbertson, R. L. y L. Ryvarden. 1987. North American polyporus, vol. II. Fungiflora, Oslo. p. 438–885. [ Links ]
Guzmán, G. 1977. Identificación de los hongos comestibles, venenosos, alucinantes y destructores de la madera. Limusa, México, D.F. 435 p. [ Links ]
Guzmán, G. 1985. Hongos. Limusa, México, D. F. 75 p. [ Links ]
Guzmán, G. 1994. Las colecciones de hongos en México y su problemática en la biodiversidad del país. Boletín de la Sociedad Botánica de México 55:35–37 [ Links ]
Guzmán, G. 1998. Análisis cualitativo y cuantitativo sobre la diversidad de los hongos en México. In La diversidad biológica de Iberoamérica, vol. II. G. Halffter (eds.). Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo y Fondo de Cultura Económica, México. D. F. p. 111–175. [ Links ]
Guzmán, G. y T. Herrera. 1969. Macromicetos de las zonas áridas de México. II. Gasteromicetos. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Botánica 40:1–92. [ Links ]
Guzmán Dávalos, L. y G. Guzmán. 1979. Estudio ecológico comparativo entre los hongos (macromicetos) de los bosques tropicales y los de coníferas del sureste de México. Revista Mexicana de Micología 13:89–126. [ Links ]
Hawksworth, D. L. 1991. The fungal dimension of biodiversity: magnitude, signifi cance and conservation. Mycological Research 95:641–655 [ Links ]
Heredia, G. 1989. Estudio de los hongos de la Reserva de la Biosfera El Cielo, Tamaulipas. Consideraciones sobre la distribución y ecología de algunas especies. Acta Botanica Mexicana 7:1–18. [ Links ]
Herrera, T. 1994. Perspectivas de la investigación en micología. Boletín de la Sociedad Botánica de México. 55:39–44. [ Links ]
Hurley, J. 1983. Mushrooms of the northeastern woods: a visual guide. Birchfield Books, North Conway (U.S.A.) 128 p. [ Links ]
Janos, D. P. 1983. Tropical micorrizas, nutrient cycles and plant growth. In Tropical rain forest: ecology and management. S. L. Sutton, T. C. Whitmore y A. C. Chadwick (eds.). Blackwell scientific Publishers, Oxford. p. 327–345. [ Links ]
Kikvidze, Z. 2000. Modelling species richness and diversity in grassland communities of the central caucasus. Oikos 89:123–127. [ Links ]
Larsen, M. J. y L. A. Cobb–Poulle. 1990. Phellinus (Hymenochaetaceae). A survey of the world taxa: sinopsis fungorum 3. Fungiflora, Oslo. 206 p. [ Links ]
Lodge, J. 1993. Nutrient cycling by fungi in wet tropical forest. In Aspects of tropical mycology. S. Isaac, J. C. Frankland, R. Watting y A. J. S. Whalley (eds.). Cambridge University Press. p. 37–58. [ Links ]
Magurran, A. 1989. Ecological diversity and its measurement. Croom Helm, London. 120 p. [ Links ]
Moser, M. 1978. Keys to agaric and boleti (Polyporales, boletales, agaricales, Russulales), The White Friars, Tombridge (Great Britain). 535 p. [ Links ]
Mülleried, F. K. G. 1957. La geología de Chiapas. Gobierno Constitucional del Estado de Chiapas. Tuxtla Gutiérrez. 180 p. [ Links ]
Ryvarden L. y R. L. Gilbertson, 1993. European polypores. Gronlands Grafiske A/S, Oslo. 387 [ Links ]p.
Rzedowski, J. 1981. La vegetación de México. Limusa, México, D.F. 342 p. [ Links ]
Rzedowski, L. 1991. Diversidad y orígenes de la flora fanerogámica de México. Acta Botanica Mexicana 14:3–21. [ Links ]
Sánchez, M. 1996. Programa de educación ambiental del Parque Educativo "Laguna Bélgica", Municipio de Ocozocoautla de Espinosa, Chiapas. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D. F. 130 p. [ Links ]
Sánchez, O. y G. López. 1988. A theoretical analysis of some indices of similitary as applied to biogeographic. Folia Entomologica Mexicana 75:119–145. [ Links ]
Sánchez Jácome, M. R. y L. Guzmán Dávalos. 1997. Nuevos registros de Thelephora (Aphyllophorales, Basidiomycotina) para México. Revista Mexicana de Micología 13:70–77. [ Links ]
San Martín, F., J. D. Rogers y Y. M. Ju. 1998. Clave dicotómica provisional para los géneros de la familia Xylariaceae (Pyrenomycetes, Sphaeriales) de México. Acta Botanica Mexicana 42:35–41. [ Links ]
Sierra, S. 1992. Contribución al estudio taxonómico de algunos hongos tremeloides (Heterobasidiomycetes) del centro y sur de México. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F. 104 p. [ Links ]
Toledo, V. M. 1988. La diversidad biológica de México. Ciencia y Desarrollo 81:1730. [ Links ]
Villegas, M. y J. Cifuentes. 1988. Revisión de algunas especies del género Ramaria subgénero Lentoramaria en México. Revista Mexicana de Micología 4:185–200. [ Links ]
Whalley, A.J.S. 1993. Tropical Xylariaceae: their distribution and ecological characteristics. In Aspects of tropical mycology. S. Isaac, J. C. Frankland, R. Watting y A. J. S. Whalley (eds.). Cambridge University Press. 103–120. [ Links ]