Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.75 no.2 Ciudad de México abr. 2005
Revisión de temas cardiológicos
Ecocardiografía en la valvulopatía mitral
Echocardiography in mitral valve disease
Leonardo Rodríguez*
* Centro de Imágenes Cardiovasculares. Cleveland Clinic Foundation.
Correspondencia:
L. Leonardo Rodríguez MD,
FACC. 9500 Euclid Avenue Desk F–15 Cleveland
Clinic Foundation Cleveland, Ohio USA.
Teléfono: 216 445 2149
Recibido: 16 de mayo de 2005
Aceptado: 30 de mayo de 2005
Resumen
La ecocardiografía se ha convertido en el método principal para la evaluación de las enfermedades valvulares. En el caso de la valvulopatía mitral, el ecocardiograma provee información detallada acerca de la anatomía y función ventricular. El uso de este método nos ha permitido el ahondar en el conocimiento de los mecanismos que participan en la génesis de insuficiencia mitral. El eco no sólo nos permite detectar la presencia de insuficiencia mitral sino también cuantificar su severidad, la cual contribuye al pronóstico del paciente. La ecocardiografía intraoperatoria ha servido para guiar los procedimientos quirúrgicos de reparación y mejorar sus resultados. Las nuevas técnicas dirigidas al tratamiento percutáneo de la insuficiencia mitral se apoyan fuertemente en la ecocardiografía para el monitoreo en tiempo real de estos procedimientos.
Palabras clave: Valvulopatía mitral. Eco diagnóstico en valvulopatía mitral. Eco intraoperatorio en valvulopatía mitral.
Summary
Echocardiography has become the premier method for the evaluation of valvular heart disease. In mitral valve disease, echo provides detailed anatomic and functional information. Using echo has allowed us to increase our understanding of the mechanisms that play a role in mitral regurgitation. Echocardiography not–only detects the presence of mitral regurgitation (MR) but also allows quantification of its severity. The importance of quantitative data forthe prognosis of patients with MR has been shown recently. Intraoperative echo has been very helpful in guiding surgical repair and improving its results. The new techniques for percutaneous treatment of mitral regurgitation strongly rely on echo for on–line monitoring of device deployment and immediate results. (Arch Cardiol Mex 2005; 75:188–196)
Keywords: Mitral valvulopathy. Echocardiography in mitral valvulopathy. Intraoperative echo in mitral valvulopathy.
Introducción
Desde su aplicación clínica inicial por el Dr. Edler en 1953 para la evaluación de la válvula mitral, la ecocardiografía se ha convertido en el método principal para la evaluación de la enfermedad valvular.
Los estudios iniciales con eco modo M mostraron los movimientos normales de las valvas mitrales y permitieron establecer los parámetros diagnósticos para la estenosis mitral, prolapso mitral y movimiento sistólico anterior, sin embargo, el diagnóstico de insuficiencia mitral escapó a las posibilidades diagnósticas del modo M.
El desarrollo y posterior refinamiento del eco bidimensional abrió nuevas fronteras y permitió la visualización detallada de todo el aparato valvular mitral y tricuspídeo, la estructura de la válvula aórtica y su raíz, y la válvula pulmonar.
Con el advenimiento del Doppler fue posible añadir el aspecto funcional al anatómico. Fue posible por primera vez el cálculo no invasivo de gradientes transvalvulares y el mapeo de chorros regurgitantes. En 1984 fue desarrollado el mapeo Doppler con color que permitió la visualización de las velocidades del flujo sanguíneo en tiempo real. Su aplicación en lesiones regurgitantes cumplió un objetivo largamente añorado desde los tiempos de Edler. El siguiente avance significativo fue la introducción del eco transesofágico inicialmente en Europa y luego popularizado en el resto del mundo. La ventana transesofágica abrió una visión de alta resolución sin los impedimentos ni obstrucciones del eco de superficie. Su contribución en la enfermedad valvular ha sido extensa en el diagnóstico de endocarditis y sus complicaciones, en particular absceso periaórtico, ruptura de cuerdas, perforaciones y trombosis de válvulas protésicas. No menos importante, nos dio la oportunidad de evaluar en el quirófano el resultado de la reparación valvular.
Estenosis mitral
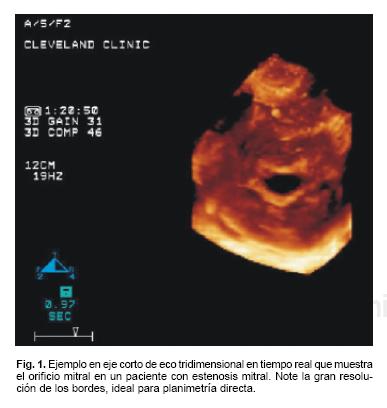
Evaluación anatómica: la enfermedad reumática sigue siendo la causa más frecuente de estenosis mitral. En esta patología la ecocardiografía provee detalles anatómicos tanto del aparato mitral como del subvalvular. El eje corto a nivel del borde libre mitral nos ofrece una visión del orificio anatómico que en muchos casos es adecuado para la planimetría directa de la válvula.1 Este método tiene la ventaja de no necesitar suposiciones geométricas y puede ser aplicado en pacientes con fibrilación auricular y lesiones regurgitantes asociadas. El uso de eco 3D podría mejorar la definición de los bordes del orificio mitral y facilitar la planimetría2 (Fig. 1). La evaluación semicuantitativa del grado de calcificación, engrosamiento y movilidad valvular y el grado de engrosamiento y de acortamiento subvalvular son de importancia crítica en pacientes candidatos para valvuloplastía percutánea. No sólo el éxito a corto plazo sino la probabilidad de reestenosis están estrechamente ligadas al grado de deformidad valvular y subvalvular. El grado de asimetría en la calcificación comisural ha sido reportado como uno de los determinantes del desarrollo de insuficiencia mitral después de valvuloplastía.
El uso de Doppler continuo aportó el estudio de velocidades transvalvulares máximas. Usando la ecuación de Bernoulli fue posible derivar los gradiente transvalvulares como otra medida de la severidad de la lesión.
La cuantificación de área valvular se inició con el uso de la planimetría directa. Posteriormente otros métodos fueron descritos para el cálculo del área valvular. El más comúnmente utilizado es el del tiempo de hemipresión. Este método desarrollado por la Dra. Hatle,3 establece que el tiempo de caída de la presión diastólica pico a la mitad de su valor inicial, está inversamente relacionado con el área valvular mitral: AVM = 220/T1/2P siendo 220 una constante empírica. Thomas y col.4 ahondaron en los fundamentos físicos y fisiológicos de esta medida y concluyó en sus elegantes estudios que el tiempo de hemipresión además de su relación con el área valvular está directamente relacionado con el gradiente inicial y la "compliance" auriculoventricular neta.
La correlación del tiempo de hemipresión con el área valvular medida por hemodinamia es bastante buena en general y su medición es bastante sencilla y rápida.
Otras técnicas para el cálculo del área valvular menos populares por ser más complejas fueron desarrolladas, incluyendo la ecuación de continuidad y la aceleración proximal.
La ecocardiografía también aportó datos anatómicos importantes tales como el grado de deformación, calcificación, así como el grado de fusión comisural. La aplicación clínica de estos datos anatómicos fue condensada en un puntaje ecocardiográfico desarrollado para pacientes considerados para valvuloplastía mitral percutánea. Wilkins y Abascal5,6 diseñaron un puntaje basado en 4 parámetros morfológicos: grosor, movilidad, calcificación de las valvas mitrales y el grado de compromiso del aparato subvalvular. Otros autores han confirmado la importancia de estos hallazgos.7,8 El grado de deformidad y calcificación valvular detectados por eco están también directamente relacionados con el resultado a corto plazo, incidencia de reestenosis y pronóstico a largo plazo en estos pacientes.8–10 Este puntaje ha ayudado enormemente en la selección adecuada de pacientes para este procedimiento.
Insuficiencia mitral
Ésta es tal vez la patología donde la ecocardiografía ha tenido un impacto más profundo. El eco bidimensional nos permite visualizar en vivo todos los componentes del aparato mitral y en funcionamiento. El uso conjunto con Doppler ha mejorado nuestra comprensión de la relación entre anatomía y función. El uso del eco transesofágico intraoperatorio ha permitido guiar los procedimientos quirúrgicos de reparación mitral y mejorar sus resultados. Más recientemente el uso del eco tridimensional nos ha permitido explorar el mecanismo de la insuficiencia mitral en cardiopatía isquémica y miocardiopatía dilatada.11
Estructura y función
El eco bidimensional nos da información estructural detallada del aparato mitral. Nos permite la medición del diámetro del anillo mitral y grado de calcificación, ver las valvas y analizar cada uno de sus segmentos y también visualizar las cuerdas tendíneas y su integridad. Algunas alteraciones fisiopatológicas son obvias con sólo mirar la anatomía. El ejemplo típico es el prolapso con ruptura de cuerdas tendinosas. La anormalidad morfológica nos muestra la localizacion de la lesión (central, lateral, medial). Por lo general la extensión del segmento roto se correlaciona con la severidad de la insuficiencia mitral.
En la enfermedad degenerativa mitral (degeneración mixomatosa) hay afectación de todos los componentes del aparato mitral. El anillo está dilatado, las valvas son redundantes y las cuerdas tendíneas elongadas. Los elegantes trabajos de Levine usando eco tridimensional nos mostraron la estructura no planar del anillo mitral.12,13 Esto permitió refinary mejorar el diagnóstico de esta patología. Es por ello que el diagnóstico de prolapso actualmente se hace en la vista del eje largo paraesternal, cuando una o ambas valvas tienen desplazamiento sistólico superior más allá del plano del anillo mitral. El eco Doppler con mapeo a color nos muestra que la dirección del chorro regurgitante es opuesta a la valva comprometida. La definición precisa de la patología es importante para planear el tratamiento quirúrgico. Es necesario saber si el prolapso es anterior, posterior o de ambas valvas; cuál segmento o festón está afectado en particular y si hay compromiso de la comisura.
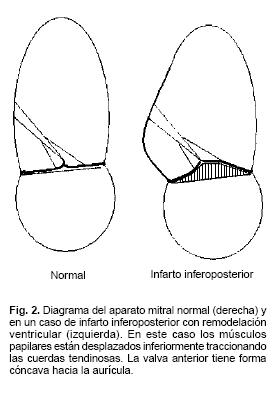
A diferencia del prolapso y ruptura de cuerdas donde la anatomía claramente muestra la fisiopatología de la lesión, en los casos de miocardiopatía dilatada e isquémica la relación entre anatomía y función es más compleja. En ambos casos la relación entre la forma y contractilidad del ventrículo izquierdo y el aparato subvalvular son la clave para entender esta patología. La dilatación global o regional del ventrículo izquierdo desplaza los músculos papilares inferior y lateralmente.11,14,15 Esto lleva a traccionar las cuerdas tendinosas y éstas a las valvas mitrales, ocasionando una morfología en tienda de campaña ("tenting") con el consecuente cierre incompleto e insuficiencia mitral (Fig. 2). El grado de "tenting" y su contribución a la insuficiencia mitral ha sido estudiado mejor con el eco tridimensional. El entendimiento de la fisiopatología de esta condición ha permitido explicar el porqué del fallo frecuente de la anuloplastía mitral en pacientes con insuficiencia mitral isquémica. Kwan y col16 estudiaron 26 pacientes con insuficiencia mitral isquémica y 18 con miocardiopatía dilatada usando eco 3D en tiempo real. En la mayoría de los pacientes con insuficiencia mitral isquémica se observaron 2 chorros regurgitantes, siendo el mayor el originado lateralmente. Al igual que en otros estudios publicados, el grado de "tenting" se correlacionó significativamente con la severidad de la insuficiencia mitral. Recientemente Nestay col.17 han propuesto un signo visual rápido de cierre incompleto mitral. Ellos han descrito que la forma cóncava hacia la aurícula izquierda de la valva anterior de la mitral se correlaciona mejor con el grado de insuficiencia mitral que el grado de "tenting". Este signo ecocardiográfico no pretende ser cuantitativo pero es una ayuda visual práctica y rápida.
Cuantificación de la severidad de la insuficiencia mitral
Una infinidad de técnicas han sido descritas para la semicuantificación o cuantificación de la insuficiencia mitral.
El mapeo Doppler a color es el más sencillo y rápido de aplicar. La longitud o profundidad del chorro regurgitante dentro de la aurícula y el área de la turbulencia con respecto al tamaño de la aurícula (visual o por planimetría) son herramientas de la práctica diaria. Estos métodos aunque fáciles de aplicar tienen limitaciones sustanciales. El color del chorro regurgitante representa un mapa de velocidades no de flujo. El jet al entrar en la aurícula izquierda "arrastra" sangre de la aurícula aumentando su volumen pero disminuyendo de velocidad (conservación de momento).18,19 Por otra parte el mapeo a color de este chorro regurgitante está influenciado por parámetros del equipo de ultrasonido: ganancias, PRF, límite Nyquist, y parámetros fisiológicos: presión arterial, volemia. Otro factor que afecta el tamaño del chorro es la dirección de éste.20 Aquellos dirigidos centralmente en la aurícula aparecen más grandes en el mapeo a color que aquellos excéntricos que corren a lo largo de la pared aunque el volumen regurgitante sea similar. Debido a estas limitaciones, métodos más cuantitativos basados en el mapeo a color han sido propuestos:
Vena contracta. Cuando un flujo pasa a través de un orificio restringido el chorro producido converge en un punto inmediatamente distal al orificio. El diámetro del chorro al converger es menor que el diámetro del orificio anatómico. Este punto donde el chorro adquiere su diámetro menor es llamado vena contracta21–24 (Fig. 3). La vena contracta puede ser visualizada usando el mapeo Doppler a color como la zona más estrecha del chorro regurgitante distal a la válvula mitral. Algunas consideraciones prácticas son importantes tales como usar magnificación del área y colocar la zona focal al nivel de la vena contracta.22 Las mejores vistas para la medición de la vena contracta son el eje paraesternal largo y la vista apical de 3 cámaras. Un diámetro mayor de 0.7 cm es considerado insuficiencia mitral severa.25
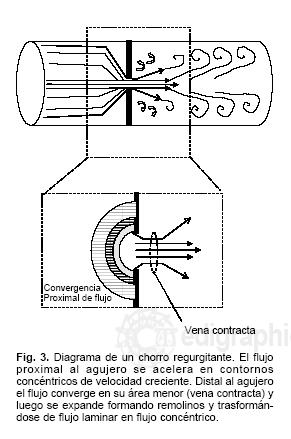
Zona proximal de convergencia de flujo o de aceleración proximal. Como puede verse en el diagrama de la Figura 3, por la ley de la conservación de la masa, el flujo proximal al orificio debe ser igual al flujo a través del orificio. Para que esto sea posible el flujo se acelera al acercarse al orificio en una serie de contornos concéntricos con velocidades en incremento y diámetros progresivamente menores. En condiciones ideales, en un orificio circular pequeño sobre una superficie plana, estos contornos de isovelocidades tienen una forma hemiesférica. Por el principio de continuidad, el flujo en cada uno de estos contornos hemiesféricos es igual, y a su vez igual al flujo a través del orificio valvular. Si podemos calcular el área de cualquiera de estos contornos y estimar su velocidad podemos calcular el flujo (flujo = área x velocidad). Si asumimos que la forma de los contornos de isovelocidad es hemiesférica entonces,
Área de la hemiesfera = 2πr2
Flujo = 2πr2 x velocidad26
La velocidad de la hemiesfera la obtenemos del mapa a color donde ocurre el primer "aliasing". Utilizando esta metodología también ha sido posible calcular el área efectiva del orificio regurgitante (AOR). Esta área es ligeramente menor que el orifico anatómico, pero su concepto es muy importante ya que representa una variable directamente relacionada con la severidad de la regurgitación. El cálculo del orificio regurgitante se realiza dividiendo el flujo por la velocidad máxima a través del orificio.
AOR = flujo regurgitante/velocidad máxima (Doppler continuo)
Un AOR mayor de 0.4 cm2 corresponde a insuficiencia mitral severa.25 Este método tiene varias limitaciones que vale la pena conocer. Una es el hecho de que asumimos una forma hemiesférica proximal sobre una superficie plana. El caso más evidente donde esto no es así y que lleva a sobreestimar el grado de insuficiencia, es en casos de prolapso mitral o rotura de cuerda tendinosa. En estos casos el segmento prolapsante no es plano y en muchos casos la zona proximal de flujo queda constreñida por la pared de la aurícula, previniendo el desarrollo de una hemiesfera completa.27 En modelos en vitro se sabe que al acercarse al orificio los contornos de isovelocidad son progresivamente más planos y el asumir una hemiesfera no es totalmente correcto. A pesar de estas limitaciones éste es un método que ha probado ser bastante útil en la práctica ecocardiográfica.
Métodos volumétricos: estos métodos se basan en obtener la diferencia entre el volumen latido total y el volumen latido efectivo. El volumen total es aquel que pasa a través de la válvula mitral y el efectivo aquel que sale por la aorta. En casos de insuficiencia mitral, el volumen mitral es mayor que el aórtico.
Para calcular el volumen mitral o total hay 2 métodos. Uno es medir el volumen diastólico final y el volumen sistólico final con eco bidimensional y calcular así el volumen latido. El otro método es medir el área del anillo mitral y multiplicarlo por la integral del tiempo velocidad (ITV). El volumen latido aórtico o efectivo se calcula midiendo el área del tracto de salida aórtico a nivel de la inserción de las valvas aórticas y multiplicándolo por la ITV (integral de flujo) a este nivel. La diferencia entre ambos volúmenes constituye el volumen regurgitante y de éste puede derivarse la fracción regurgitante (Tabla I). Este método es bastante sólido con pocas suposiciones geométricas. Tiene como desventaja que toma tiempo y no puede usarse cuando hay lesiones aórticas asociadas. La Sociedad Americana de Ecocardiografía ha publicado sus recomendaciones para la evaluación de la severidad de la regurgitación valvular25 y debe ser revisado por aquellos interesados en este tema.

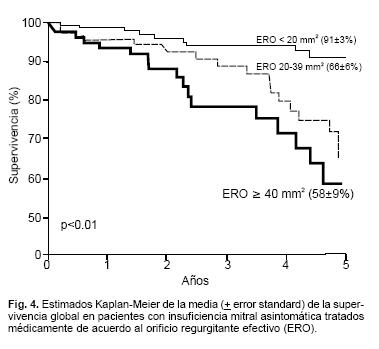
La importancia de la cuantificación en esta patología ha sido demostrada recientemente en un trabajo que muestra que el pronóstico de los pacientes está relacionado con el tamaño del orificio regurgitante (Figs. 4 y 5). En este trabajo publicado por el grupo de la Clínica Mayo, 456 pacientes asintomáticos con insuficiencia mitral fueron seguidos alrededor de 5 años.28 En este grupo de pacientes la supervivencia estuvo relacionada con los parámetros cuantitativos de insuficiencia mitral. El parámetro que se relacionó más fuertemente con el pronóstico fue el área del orificio regurgitante. Este estudio subraya la importancia de cuantificar la severidad de la insuficiencia mitral.
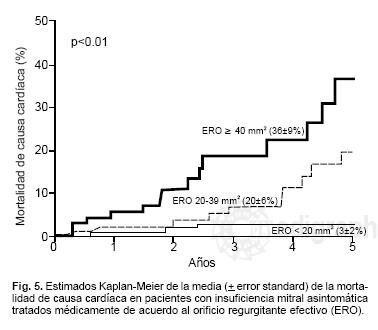
Otros datos semicuantitativos para evaluar la severidad de la insuficiencia mitral:
El Doppler pulsado ofrece datos que nos ayudan a corroborar lo aportado por las técnicas arriba mencionadas. El Doppler pulsado del flujo mitral nos permite cuantificar la velocidad máxima de la onda E. En casos de insuficiencia severa el pico de la onda E es mayor de 1 m/seg. Esto es aplicable sólo en pacientes que no tengan estenosis mitral asociada. El Doppler de las venas pulmonares muestra disminución marcada de la onda sistólica en regurgitaciones moderada a severa, y reverso sistólico en casos de regurgitación severa. Este parámetro es afectado por la distensibilidad de la aurícula izquierda, la dirección del chorro regurgitante, fibrilación auricular y función ventricular. La sensibilidad y especificidad de flujo retrógrado sistólico en las venas pulmonares para predecir insuficiencia mitral significativa (AOR > 0.3) es 69% y 98% respectivamente.29
La curva del Doppler continuo del chorro regurgitante también está correlacionada con el grado de insuficiencia. En casos severos el contorno espectral es completo y sólido. Por último y de importancia pronostica es el tamaño de la cavidad ventricular con dilatación diastólica del ventrículo izquierdo. En pacientes con insuficiencia crónica la función ventricular es inicialmente hiperdinámica con fracción de eyección > 65%. En estadios tardíos hay incremento progresivo de los diámetros ventriculares. Un diámetro sistólico final > 4.5 cm es criterio para cirugía mitral.30
Ecocardiografía intraoperatoria para guiar la cirugía de reparación mitral
Uno de los usos más importantes del eco transesofágico intraoperatorio es como adjunto a la cirugía de reparación mitral. Aunque en la mayor parte de los casos la anatomía y severidad de la lesión han sido previamente establecidos, la sala operatoria nos ofrece la última oportunidad para evaluar el mecanismo, severidad y lesiones asociadas. Dada la exquisita definición anatómica nos es posible ver cuerdas tendinosas rotas, vegetaciones y perforaciones. En casos de prolapso mitral podemos establecer el segmento comprometido y ayudar al cirujano en su planificación. El mejor entendimiento en la patología de la insuficiencia mitral isquémica llevará al desarrollo de mejores técnicas de reparación mitral.31
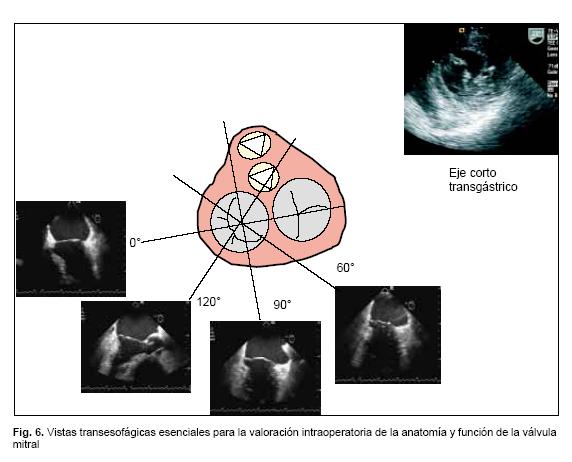
Es importante tener un abordaje sistemático en la sala quirúrgica. Las vistas de 4 cámaras (0º), bicomisural (50–70°), 2 cámaras (90°) y eje largo (110–130°) permiten analizar cada uno de los segmentos de la valva anterior y posterior de la mitral. Aunque el eje corto transgástrico a nivel mitral puede ser difícil de obtener, al menos debe intentarse en todos los casos. La dirección y el origen del chorro regurgitantes también son elementos importantes. El ETE nos ofrece también acceso al flujo de las venas pulmonares para interrogación con Doppler pulsado. Después de la cirugía de reparación mitral el análisis sistemático debe ser repetido en búsqueda de insuficiencia residual. El ETE es también útil para detectar movimiento sistólico anterior de la válvula mitral con obstrucción del tracto de salida del VI que es una complicación posible de la reparación mitral.
Ecocardiografía en las nuevas técnicas de reparación mitral percutánea
Nuevas técnicas que están siendo desarrolladas permiten el abordaje percutáneo para la reparación mitral. En los actuales momentos hay 2 maneras de tratar el problema. Uno consiste en la reparación de las valvas y la otra en anuloplastía percutánea. El primer abordaje se ha hecho colocando una grapa en la parte media de la valva anterior y posterior que permite la aproximación de sus bordes libres creando un doble orificio mitral. Esta técnica ya ha sido puesta en práctica en humanos. El estudio EVEREST I aplicó esta técnica en 27 pacientes y demostró que es posible hacerlo, que es seguro y que permite reducir, si bien no eliminar, la insuficiencia mitral. Esta grapa se coloca bajo monitoreo radiológico y ecocardiográfico tanto por ETE como ETT. Requiere alto nivel de competencia en ambas modalidades y conocimiento detallado de la anatomía y función de la válvula mitral.
La anuloplastía percutánea se basa en la vecindad anatómica del seno coronario y la parte posterior del anillo posterior mitral. En experimentos animales ha sido posible colocar dispositivos dentro del seno coronario que permiten reducir el diámetro del anillo alrededor de un 25%.32,33 Esta técnica, que parece prometedora, aún no ha sido probada en humanos.
Conclusión
La ecocardiografía es una herramienta fundamental en la evaluación de la patología mitral. Nos ha permitido conocer la anatomía y fisiopatología en tiempo real, la historia natural de la enfermedad, guiar los procedimientos terapéuticos y participar en las nuevas fronteras en el tratamiento percutáneo de la enfermedad mitral.
Referencias
1. Bareiss P, Warter J, Kieny R, Class JJ, Eisenmann B, Charbel P, et al: [Real–time cross–sectional echocardiography. Application in the measurement of the surface area of the mitral orifice in cases of stenosis or of double involvement of the valve (author's transl)]. Nouv Presse Med 1979; 8: 3329–33. [ Links ]
2. Zamorano J, Cordeiro P, Sugeng L, Perez de Isla L, Weinert L, Macaya C, et al: Real–time three–dimensional echocardiography for rheumatic mitral valve stenosis evaluation: an accurate and novel approach. J Am Coll Cardiol 2004; 43: 2091–6. [ Links ]
3. Hatle L, Brubakk A, Tromsdal A, Angelsen B: Noninvasive assessment of pressure drop in mitral stenosis by Doppler ultrasound. Br Heart J 1978; 40: 131–40. [ Links ]
4. Thomas JD, Weyman AE: Doppler mitral pressure half–time: a clinical tool in search of theoretical justification. J Am Coll Cardiol 1987; 10: 923–9. [ Links ]
5. Wilkins GT, Weyman AE, Abascal VM, Block PC, Palacios IF: Percutaneous balloon dilatation of the mitral valve: an analysis of echocardiographic variables related to outcome and the mechanism of dilatation. Br Heart J 1988; 60: 299–308. [ Links ]
6. Abascal VM, Wilkins GT, Choong CY, Thomas JD, Palacios IF, Block PC, et al. Echocardiographic evaluation of mitral valve structure and function in patients followed for at least 6 months after percutaneous balloon mitral valvuloplasty. J Am Coll Cardiol 1988; 12: 606–15. [ Links ]
7. Reid CL, Chandraratna PA, Kawanishi DT, Kotlewski A, Rahimtoola SH: Influence of mitral valve morphology on double–balloon catheter balloon valvuloplasty in patients with mitral stenosis. Analysis of factors predicting immediate and 3–month results. Circulation 1989; 80: 515–24. [ Links ]
8. Reid CL, Otto CM, Davis KB, Labovitz A, Kisslo KB, McKay CR: Influence of mitral valve morphology on mitral balloon commissurotomy: immediate and six–month results from the NHL–BI Balloon Valvuloplasty Registry. Am Heart J 1992; 124: 657–65. [ Links ]
9. Dean LS, Mickel M, Bonan R, Holmes DR Jr, O'Neill WW, Palacios IF, et al: Four–year follow–up of patients undergoing percutaneous balloon mitral commissurotomy. A report from the National Heart, Lung, and Blood Institute Balloon Valvuloplasty Registry. J Am Coll Cardiol 1996; 28: 1452–7. [ Links ]
10. Iung B, Garbarz E, Michaud P, Helou S, Farah B, Berdah P, et al: Late results of percutaneous mitral commissurotomy in a series of 1,024 patients. Analysis of late clinical deterioration: frequency, anatomic findings, and predictive factors. Circulation 1999; 99: 3272–8. [ Links ]
11. Otsuji Y, Gilon D, Jiang L, He S, Leavitt M, Roy MJ, et al: Restricted diastolic opening of the mitral leaflets in patients with left ventricular dysfunction: evidence for increased valve tethering. J Am Coll Cardiol 1998; 32: 398–404. [ Links ]
12. Levine RA, Triulzi MO, Harrigan P, Weyman AE: The relationship of mitral annular shape to the diagnosis of mitral valve prolapse. Circulation 1987; 75: 756–67. [ Links ]
13. Levine RA, Handschumacher MD, Sanfilippo AJ, Hagege AA, Harrigan P, Marshall JE, et al: Three–dimensional echocardiographic reconstruction of the mitral valve, with implications for the diagnosis of mitral valve prolapse. Circulation 1989; 80: 589–98. [ Links ]
14. Otsuji Y, Handschumacher MD, Liel–Cohen N, Tanabe H, Jiang L, Schwammenthal E, et al: Mechanism ofischemic mitral regurgitation with segmental left ventricular dysfunction: three–dimensional echocardiographic studies in models of acute and chronic progressive regurgitation. J Am Coll Cardiol 2001; 37: 641–8. [ Links ]
15. Kumanohoso T, Otsuji Y, Yoshifuku S, Matsukida K, Koriyama C, Kisanuki A, et al: Mechanism of higher incidence ofischemic mitral regurgitation in patients with inferior myocardial infarction: quantitative analysis of left ventricular and mitral valve geometry in 103 patients with prior myocardial infarction. J Thorac Cardiovasc Surg 2003; 125: 135–43. [ Links ]
16. Kwan J, Shiota T, Agler DA, Popovic ZB, Qin JX, Gillinov MA, et al: Geometric differences of the mitral apparatus between ischemic and dilated cardiomyopathy with significant mitral regurgitation: real–time three–dimensional echocardiography study. Circulation 2003; 107: 1135–40. [ Links ]
17. Nesta F, Otsuji Y, Handschumacher MD, Messas E, Leavitt M, Carpentier A, et al: Leaflet concavity: a rapid visual clue to the presence and mechanism of functional mitral regurgitation. J Am Soc Echocardiogr 2003; 16: 1301–8. [ Links ]
18. Cape EG, Skoufis EG, Weyman AE, Yoganathan AP, Levine RA: A new method for noninvasive quantification of valvular regurgitation based on conservation of momentum. In vitro validation. Circulation 1989; 79: 1343–53. [ Links ]
19. Thomas JD, Liu CM, Flachskampf FA, O'Shea JP, Davidoff R, Weyman AE: Quantification of jet flow by momentum analysis. An in vitro color Doppler flow study. Circulation 1990; 81: 247–59. [ Links ]
20. Chen CG, Thomas JD, Anconina J, Harrigan P, Mueller L, Picaro MH, et al: Impact of impinging wall jet on color Doppler quantification of mitral regurgitation. Circulation 1991; 84: 712–20. [ Links ]
21. Lesniak–Sobelga A, Olszowska M, Pienazek P, Podolec P, Tracz W: Vena contracta width as a simple method of assessing mitral valve regurgitation. Comparison with Doppler quantitative methods. J Heart Valve Dis 2004; 13: 608–14. [ Links ]
22. Roberts B J, Grayburn PA: Color flow imaging of the vena contracta in mitral regurgitation: technical considerations. J Am Soc Echocardiogr 2003; 16: 1002–6. [ Links ]
23. Quere JP, Tribouilloy C, Enriquez–Sarano M: Vena contracta width measurement: theoretic basis and usefulness in the assessment of valvular regurgitation severity. Curr Cardiol Rep 2003; 5: 110–5. [ Links ]
24. Zhou X, Jones M, Shiota T, Yamada I, Teien D, Sahn DJ. Vena contracta imaged by Doppler color flow mapping predicts the severity of eccentric mitral regurgitation better than color jet area: a chronic animal study. J Am Coll Cardiol 1997; 30: 1393–8. [ Links ]
25. Zoghbi WA, Enriquez–Sarano M, Foster E, Grayburn PA, Kraft CD, Levine RA, et al: Recommendations for evaluation of the severity of native valvular regurgitation with two–dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003; 16: 777–802. [ Links ]
26. Bargiggia GS, Tronconi L, Sahn DJ, Recusani F, Raisaro A, De Serví S, et al: A new method for quantitation of mitral regurgitation based on color flow Doppler imaging of flow convergence proximal to regurgitant orifice. Circulation 1991; 84: 1481–9. [ Links ]
27. Pu M, Vandervoort PM, Greenberg NL, Powell KA, Griffin BP, Thomas JD: Impact of wall constraint on velocity distribution in proximal flow convergence zone. Implications for color Doppler quantification of mitral regurgitation. J Am Coll Cardiol 1996; 27: 706–13. [ Links ]
28. Enriquez–Sarano M, Avierinos JF, Messika–Zeitoun D, Detaint D, Capps M, Nkomo V, et al: Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med 2005; 352: 875–83. [ Links ]
29. Pu M, Griffin BP, Vandervoort PM, Stewart WJ, Fan X, Cosgrove DM, et al: The value of assessing pulmonary venous flow velocity for predicting severity of mitral regurgitation: A quantitative assessment integrating left ventricular function. J Am Soc Echocardiogr 1999; 12: 736–43. [ Links ]
30. Bonow RO, Carabello B, de Leon AC, Edmunds LH Jr, Fedderly BJ, Freed MD, et al: ACC/AHA Guidelines for the Management of Patients With Valvular Heart Disease. Executive Summary. A report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients With Valvular Heart Disease). J Heart Valve Dis 1998; 7: 672–707. [ Links ]
31. Messas E, Guerrero JL, Handschumacher MD, Conrad C, Chow CM, Sullivan S, et al: Chordal cutting: a new therapeutic approach for ischemic mitral regurgitation. Circulation 2001; 104: 1958–63. [ Links ]
32. Kaye DM, Byrne M, Alferness C, Power J: Feasibility and short–term efficacy of percutaneous mitral annular reduction for the therapy of heart failure–induced mitral regurgitation. Circulation 2003; 108: 1795–7. [ Links ]
33. Daimon M, Shiota T, Gillinov AM, Hayase M, Ruel M, Cohn WE, et al: Percutaneous mitral valve repair for chronic ischemic mitral regurgitation: a real–time three–dimensional echocardiographic study in an ovine model. Circulation 2005; 111: 2183–9. [ Links ]