Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Agrociencia
On-line version ISSN 2521-9766Print version ISSN 1405-3195
Agrociencia vol.42 n.6 Texcoco Aug./Sep. 2008
Protección vegetal
Efecto del extracto crudo y los compuestos bioactivos de Heliopsis longipes sobre la incidencia de la antracnosis, micorrización y nodulación del frijol
Effect of crude extract and bioactive compounds of Heliopsis longipes on anthracnose incidence, mycrrhization, and nodulation of bean
Rafael Salgado–Garciglia1, Jorge Molina–Torres2, Joel E. López–Meza3 y Pedro D. Loeza–Lara4,*
1 Instituto de Investigaciones Químico–Biológicas, U.M.S.N.H., Morelia, Michoacán, México.
2 Departamento de Biotecnología y Bioquímica, CINVESTAV–I.P.N., Unidad Irapuato, Guanajuato, México.
3 Centro Multidisciplinario de Estudios en Biotecnología F.M.V.Z., U.M.S.N.H., Morelia, Michoacán, México.
4 Genómica Alimentaria, Universidad de la Ciénega del Estado de Michoacán de Ocampo, Sahuayo, Michoacán, México. * Autor responsable: (pedrodamian1@lycos.com).
Recibido: Abril, 2007.
Aprobado: Junio, 2008.
Resumen
Para el control de la antracnosis del frijol (Phaseolus vulgaris L.) en invernadero y campo, se evaluó el efecto del extracto crudo (EC) y la mezcla de compuestos bioactivos afinina (A) y decatrién bornilo (DB), obtenidos de la raíz de Heliopsis longipes 'A. Gray' Blake. También se evaluó el efecto sobre la colonización de la raíz del frijol por hongos micorrízicos vesículo arbusculares (HMVA) y la nodulación de bacterias fijadoras de nitrógeno. En invernadero, dos de las concentraciones del EC (700/70 y 70/7 µg mL–1) y A/DB (700/70 y 70/7 µg mL–1), redujeron la incidencia de la antracnosis en 90%, sin reducción significativa (p>0.05) del peso seco de las plantas tratadas. En campo, las concentraciones evaluadas de EC (70/7 µg mL–1) y A/DB (70/7 µg mL–1), redujeron la incidencia de la antracnosis en 88%, sin efecto significativo sobre el peso seco de las plantas tratadas (p>0.05), lo que confirmó la capacidad de estos compuestos para reducir la enfermedad. La aplicación del EC y la mezcla A/DB en campo no afectó el establecimiento de HMVA y bacterias fijadoras de nitrógeno en las raíces de frijol.
Palabras clave: Colletotrichum lindemuthianum, manejo integrado de plagas y enfermedades, metabolitos secundarios, nuevos fungicidas.
Abstract
For bean (Phaseolus vulgaris L.) anthracnose control under greenhouse and field conditions, the effect of crude extract and the mixture of bioactive afinina (A) compounds and bornyl decatrién (DB) obtained from Heliopsis longipes 'A. Gray' Blake root was assessed. Besides, the effect on bean root colonization by shrub vesicle mycorrhizal fungi (HMVA) and nodulation of nitrogen–fixing bacteria was evaluated. Two of the EC concentrations (700/70 and 70/7/µg mL–1) and A/DB (700/70 and 70/7 µg mL–1), under greenhouse conditions, reduced anthracnose incidence by 90%, without significant reduction (p > 0.05) of dry weight of the treated plants. Under field conditions, the evaluated EC concentrations (70/7 µg mL–1) and A/DB (70/7 µg mL–1) reduced anthracnose incidence reduction by 88%, without significant effect on dry weight of the treated plants (p>0.05), which confirmed the capacity of these compounds to reduce the disease. Application of EC and A/DB mixture under field conditions did not affect establishment of HMVA and nitrogen–fixing bacteria in bean roots.
Key words: Colletotrichum lindemuthianum, integrated pest and disease management, secondary metabolites, new fungicides.
INTRODUCCIÓN
La antracnosis del frijol (Phaseolus vulgaris L.), ocasionada por el hongo Colletotrichum lindemuthianum (Sacc & Magnus) Lams.–Scrib., es la enfermedad más importante de este cultivo en las zonas de temporal en México (Mendoza–Zamora, 1991), y puede ser devastadora cuando las condiciones climáticas favorecen al patógeno (González et al., 1998). Ataca diversas partes de las plantas, particularmente vainas y reduce 20 a 30% el rendimiento (Pastor et al., 1995). Para controlar esta enfermedad frecuentemente se usan fungicidas sintéticos, pero su aplicación extensiva y sin control adecuado ha provocado efectos adversos en el ecosistema y en la salud humana, lo que ha inducido la búsqueda de métodos de control alternativos de bajo riesgo (Okigbo y Ogbonnaya, 2006). Los metabolitos secundarios vegetales o compuestos bioactivos con propiedades fungicidas son una opción en el manejo de patógenos que transmiten enfermedades, ya que actúan contra un número limitado de especies, son biodegradables a productos no tóxicos, tienen bajo impacto en la salud humana y se pueden incorporar en programas de manejo integrado de plagas y enfermedades, por lo que a partir de ellos podrían desarrollarse nuevos agentes de control (Lee et al., 2001; Key et al., 2003).
Las raíces de chilcuague Heliopsis longipes 'A. Gray' Blake (Asteraceae) se usan como anestésico local, desparasitante y condimento de alimentos (Martínez, 1994); además tienen actividad insecticida (Fisher, 1957) y fungicida (Ramírez–Chávez et al., 2000). En experimentos in vitro se ha mostrado que el extracto crudo (EC) de la raíz de esta planta tiene actividad fungicida contra C. lindemuthianum, ya que inhibe su crecimiento micelial y la germinación de sus esporas. Otros estudios (Molina–Torres et al., 1995 y 1996), han revelado la presencia de dos compuestos bioactivos del grupo de las alcamidas, presentes en el EC: afinina (A) y decatrién bornilo (DB) (Figura 1) como responsables de la actividad fungicida contra C. lindemuthianum, observándose un efecto fungicida equivalente al EC cuando se mezclan los compuestos puros A y DB (Covián, 1999)5.
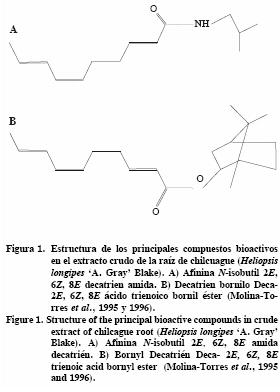
En experimentos de inhibición de la germinación de esporas se determinó la concentración letal 50 (CL50) del EC, la cual correspondió a una concentración de A de 70 µg mL–1 etanol y una concentración de DB de 7 µg mL–1 etanol. Este resultado fue confirmado mediante la evaluación de la mezcla de compuestos purificados A/DB a una concentración de 70/7 µg mL–1 etanol. La efectividad de la CL50 del EC y la mezcla A/DB para controlar la incidencia de la antracnosis se evaluó en experimentos in vivo, en laboratorio, en plantas de frijol inoculadas con esporas de C. lindemuthianum, observándose que las plantas tratadas con EC y A/DB no mostraron síntomas de la antracnosis (Covián, 1999)5. Sin embargo, se desconoce la efectividad fungicida del EC y la mezcla A/DB en invernadero y campo y, por tanto, el control de la incidencia de la antracnosis del frijol. Así mismo, no se encontró información del efecto de dichos compuestos sobre organismos simbiontes de la raíz del frijol; por ejemplo, hongos micorrízicos vesículo arbusculares (HMVA) y bacterias fijadoras de nitrógeno.
Por tanto, los objetivos de este estudio fueron evaluar el efecto del EC y la mezcla A/DB, en la incidencia de la antracnosis del frijol en invernadero y campo, así como de los compuestos bioactivos sobre las asociaciones simbióticas nativas establecidas en la raíz del frijol por HMVA y bacterias fijadoras de nitrógeno.
MATERIALES Y MÉTODOS
Este estudio se hizo en el invernadero del Instituto de Investigaciones Químico Biológicas de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH), en Morelia, Michoacán, México. Los experimentos en campo se realizaron en una parcela experimental ubicada en Tiripetío, Morelia, Michoacán, México.
Material vegetal
Las raíces de H. longipes se obtuvieron de plantas en etapa de floración del mercado local del municipio Doctor Mora, al noroeste del Estado de Guanajuato, México. Un espécimen fue identificado en el Herbario de la Facultad de Biología de la UMSNH, por la Botánica Luz del Socorro Rodríguez. Para los ensayos en invernadero y campo se usaron semillas de frijol (P. vulgaris cv. Flor de Mayo).
Obtención de esporas de C. lindemuthianum
Se usó una cepa patógena de C. lindemuthianum correspondiente a la cepa a (donada por la Dra. June Simpson del Departamento de Ingeniería Genética del CINVESTAV Unidad–Irapuato). El hongo se mantuvo creciendo 8 d en medio YEB (extracto de levadura 1 g L–1; sulfato de magnesio 0.1 g L–1; sacarosa 5 g L–1; peptona de caseína 5 g L–1; peptona de carne 5 g L–1; agar bacteriológico 10 g L–1, suplementado con vainas de frijol) a 30 °C. Luego, las esporas de C. lindemuthianum se recolectaron en agua destilada estéril y se cuantificaron en un hematocitómetro (Pastor et al., 1995). Se preparó un inoculo a 1 x 106 esporas mL–1 en agua destilada estéril, utilizado para inocular plantas de frijol mediante aspersión en los experimentos de invernadero y campo.
Obtención del EC y los compuestos A, DB
El EC se obtuvo pulverizando 10 g de material seco de la raíz, extraído por reflujo continuo durante 3 h en un sistema Soxhlet, con 65 mL de acetato de etilo (Merck®) a 70 °C. El EC fue secado a 45 °C en un rotavapor (Brinkmann/Büchi) y se disolvió en 10 mL de etanol absoluto (Merck®), almacenándose a 4 °C en oscuridad (Molina–Torres et al., 1996). La purificación de los compuestos bioactivos A y DB se realizó a partir del EC (Molina–Torres et al., 1995 y 1996), mediante cromatografía en columna utilizando gel de sílice (Sigma®) como fase estacionaria y una mezcla de n–hexano/acetato de etilo (2:1 v/v) (Merck®) como fase móvil.
Experimentos en invernadero y campo
Semillas de frijol, previamente desinfectadas con detergente extrán neutro (Merk®) (5%), etanol (70%), hipoclorito de sodio (Cloralex®) (10%) y agua destilada estéril, se sembraron en macetas de 1 L con agrolita estéril y se mantuvieron en hidroponía, con riegos cada 4 d con la solución nutritiva (0.35 g L–1 KH2PO4; 0.118 g L–1 (NH4)2SO4; 0.5 g L–1 MgSO4; 0.25 g L–1 KNO3; 0.20 g L–1 CaCl2). Se usó un diseño experimental completamente al azar con ocho tratamientos y cinco repeticiones (dos plantas por repetición); haciendo tres inoculaciones del hongo patógeno sobre las plantas de frijol a 15, 30 y 50 d después de la siembra (DDS). Para facilitar el desarrollo de la antracnosis, las plantas se mantuvieron en cámaras húmedas 7 d después de cada inoculación (Pastor et al., 1995).
Para aplicar los compuestos bioactivos, diversos vehículos se evaluaron de acuerdo con su capacidad de disolución, su efecto sobre la germinación de esporas de C. lindemuthianum y el daño visible a las plantas de frijol. La mezcla de etanol (50%) (Merck®) y Tween 20 (1%) (Sigma®), mostró los mejores resultados para obtener la disolución adecuada de los compuestos, sin efecto sobre C. lindemuthianum y sin daño visible a las plantas de frijol. Según la relación de la concentración del EC y la mezcla A/DB con la inhibición de la germinación del 50 % de las esporas de C. lindemuthianum documentada por Covián (1999)5, se seleccionaron las siguientes concentraciones de compuestos: 700/70, 70/7 y 7/0.7 µg mL–1 etanol (50%)–Tween 20 (1%), las cuales fueron aplicadas en invernadero como EC y una mezcla de compuestos purificados A/DB. Los seis tratamientos se aplicaron tres veces durante el experimento, después de cada inoculación del hongo en la etapa de plántula, desarrollo vegetativo y floración, que corresponden a los 15, 30 y 50 DDS. Como testigo regional se aplicó tiabendazol (TECTO 60®, polvo humectable, 600 g i. a. kg–1, MSD AGVET) 5 mg mL–1 agua y se usó un testigo sin tratar (S/T), para el cual se usaron plantas inoculadas con esporas de C. lindemuthianum sin aplicar ningún tratamiento fungicida, sólo los vehículos de aspersión, etanol (50%)–Tween 20 (1%).
La evaluación de los compuestos sobre la incidencia de la antracnosis se realizó a los 7, 20 y 45 d después de la primera inoculación (DDPI), con base en la escala visual de síntomas de Schoonhoven y Pastor (1987). Se contaron las plantas enfermas, y para el análisis estadístico estos datos fueron transformados a: √x+0.5 (Steel y Torrie, 1980), y la incidencia se expresó como el porcentaje de plantas enfermas (Amadioha, 2000) con la fórmula: Incidencia = número de plantas enfermas/número total de plantas X 100. El peso seco de las plantas tratadas se determinó a los 60 DDPI.
El experimento en campo se hizo en una parcela experimental de 14 x 8 m y un área de 2 m2 para cada tratamiento y se mantuvo en condiciones de temporal durante la temporada de lluvias del 2001, en un diseño de bloques completos al azar con cinco tratamientos y cuatro repeticiones. Las tres inoculaciones del hongo en las plantas de frijol y las tres aplicaciones de la concentración efectiva de EC y A/DB, así como del testigo regional y el testigo S/T, se realizaron a 15, 30 y 50 DDS. Se incluyó un testigo absoluto (plantas sin ningún tratamiento y sin inoculación), para evaluar el efecto de los compuestos en la colonización de HMVA y la nodulación de la raíz del frijol. La evaluación de los compuestos en la incidencia de la antracnosis en campo, y la determinación del peso seco de las plantas tratadas se realizó igual que en invernadero. Para evaluar el efecto del EC y la mezcla A/DB en la colonización de HMVA y la nodulación del frijol, se seleccionaron al azar 5 plantas por tratamiento a 15, 35 y 50 días después de la primera aplicación (DDPA), determinándose los porcentajes de colonización de los HMVA (Phillips y Hayman, 1970) y el número promedio de nódulos efectivos (los de color rojizo) (Samaniego–Russo et al., 1996).
Análisis estadístico
Los datos de plantas enfermas se transformaron con la función vx+0.5, y la incidencia se expresó como porcentajes de plantas enfermas (Steel y Torrie, 1980; Amadioha, 2000). Se realizó un análisis de varianza (p<0.05) y una prueba de Tukey (p<0.05), con el programa SPSS para Windows (9.0).
RESULTADOS
Control de la incidencia de la antracnosis en invernadero
La aparición de la antracnosis en las plantas de frijol fue gradual desde 7 hasta 45 DDPI, con una incidencia máxima (100% de plantas enfermas) 45 DDPI en el testigo S/T. Los tratamientos con EC (7/0.7 µg mL–1) y A/DB (7/0.7 µg mL–1), mostraron 50% de incidencia de enfermedad. Los tratamientos que controlaron significativamente la incidencia de la antracnosis (p<0.05) fueron TECTO 60, EC (700/70 y 70/7 µg mL–1) y A/DB (700/70 y 70/7 µg mL–1), con incidencias de 0 a 10% de plantas enfermas, a los 45 DDPI (Cuadro 1).
El testigo S/T, el EC (7/0.7 µg mL–1) y la mezcla A/DB (7/0.7 µg mL–1), tuvieron promedios de peso seco, 60 DDPI, de 3, 4.75 y 4.91 g, los cuales fueron diferentes del resto de los tratamientos (p<0.05). Los tratamientos con mayores promedios de peso seco fueron TECTO 60, EC (700/70 y 70/7 µg mL–1) y A/DB (700/70 y 70/7 µg mL–1), con promedios de peso seco de 11.00, 10.79, 9.64, 10.21 y 10.13 g, sin diferencias significativas (p>0.05) (Cuadro 1).
Control de la incidencia de la antracnosis en campo y efecto del EC y la mezcla A/DB en la colonización de HMVA y la nodulación de las raíces del frijol
La aparición de los síntomas de antracnosis en campo se observó a partir de los 20 DDPI, con una incidencia máxima en el testigo S/T (100% de plantas enfermas) a los 45 DDPI. Los tratamientos que controlaron significativamente la incidencia de la antracnosis (p<0.05) fueron TECTO 60, EC (70/7 µg mL–1) y A/DB (70/ 7 µg mL–1), con 0, 12 y 12% de plantas enfermas, a 45 DDPI (Cuadro 2).
El testigo S/T tuvo el promedio de peso seco (3.3 g) más bajo a 60 DDPI, mientras que los tratamientos con mayores promedios de peso seco fueron TECTO 60, EC (70/7 µg mL–1) y A/DB (70/7 µg mL–1), con promedios de peso seco de 8.49, 7.87 y 7.89 g, sin diferencias significativas (p >0.05) entre estos tres tratamientos (Cuadro 2).
Los tratamientos TECTO 60, EC (70/7 µg mL–1), A/DB (70/7 µg mL–1) el testigo absoluto mostraron, 50 DDPA, porcentajes de colonización de HMVA de 66, 66, 67 y 67%, sin diferencias estadísticas entre tratamientos. Los tratamientos TECTO 60, EC (70/7µg mL–1) A/DB (70/7 µg mL–1) y el testigo, presentaron 14, 15, 14 y 14 nódulos efectivos, 50 DDPA, sin diferencias entre tratamientos (Cuadro 3).
DISCUSIÓN
Concentraciones de 700/70 y 70/7 µg mL–1 del EC y de la mezcla A/DB, disminuyeron la incidencia de la antracnosis en 90% en invernadero, sin reducción significativa del peso seco de las plantas tratadas. Esto coincide con lo reportado por Covián (1999)5 de que el EC y A/DB son efectivos en condiciones controladas a partir de una concentración 370/7 µg mL–1. La concentración (70/7 µg mL–1) de EC y A/DB evaluada en campo fue efectiva por reducir la incidencia de antracnosis en 88 %, sin reducción significativa del peso seco de las plantas tratadas, lo que muestra la efectividad de ambas preparaciones para reducir la densidad de inóculo del hongo; evitando el establecimiento de la enfermedad en invernadero y en campo (Goes et al., 2008). La falta de protección suficiente proporcionada por los tratamientos EC (7/0.7 µg mL–1), A/DB (7/0.7 µg mL–1) y testigo S/T, favoreció la infección del patógeno y el desarrollo de los síntomas, como observaron Hidalgo y Araya (1993).
La reducción de la incidencia de la antracnosis en 90 y 88% en invernadero y campo muestra aspectos interesantes. La concentración de 70/7 µg mL–1 de EC y A/DB, mostró un efecto protector similar en condiciones controladas y no controladas; pero es importante señalar que se requirieron tres aplicaciones en condiciones no controladas de este tratamiento para controlar la antracnosis, lo que podría explicar el mismo nivel de protección en ambas condiciones. Además, la presencia de un pequeño porcentaje de plantas enfermas (10 % en invernadero y 12% en campo) que aún tienen esporas activas de C. lindemuthianum, indica que la enfermedad persistirá, aunque a niveles mínimos, como observaron Hidalgo y Araya (1993). Sin embargo, la presencia de estas esporas es importante, ya que no se pretende eliminar al patógeno, sino disminuir la densidad del inóculo a un nivel que no cause daño significativo al cultivo, conservando la calidad del ambiente (Badii et al., 1996).
Otro resultado importante es que la concentración efectiva del EC y A/DB (70/7 µg mL–1), es menor que la reportada para numerosos fungicidas sintéticos usados para controlar la antracnosis; por ejemplo, tiabendazol 5 mg mL–1 (TECTO 60®, polvo humectable, 600 g i. a. kg–1, MSD AGVET) o sulfato de cobre 40 mg mL–1 (sulfato de cobre pentahidratado, cristales solubles en agua, 250 g i. a. kg–1, Sulcona S.A. de C.V.). Esto es importante desde el punto de vista económico y de contaminación ambiental, ya que los compuestos químicos son más caros, causan mayor daño a la salud humana y son más agresivos con el ambiente y su fauna benéfica debido a sus concentraciones elevadas, alta persistencia y toxicidad (Silva–Flores et al., 2005).
El efecto de numerosos plaguicidas en organismos no blanco ha sido bien documentado (Cox, 2006). El fungicida Captan (CAPTAN® 50 WP, polvo humectable, 500 g i. a. kg–1, ZENECA) es ejemplo de un plaguicida inespecífico, debido a su efecto inhibitorio en el crecimiento de HMVA inoculados en la raíz de fresa (Ferrera et al., 1998). El efecto nulo de la concentración efectiva del EC y A/DB en la colonización de HMVA y la nodulación de las raíces del frijol en campo es importante, ya que su efecto específico en agentes patógenos causales de enfermedades es una característica que deben poseer los compuestos bioactivos para ser incluidos dentro de programas de manejo integrado de plagas y enfermedades (Gullino et al., 2000).
En esta investigación se muestra el potencial del EC y la mezcla A/DB obtenidos de la raíz de H. longipes para controlar la antracnosis en el cultivo de frijol en invernadero y campo. Estos compuestos pueden proteger al frijol al mismo nivel que el fungicida sintético evaluado, TECTO 60®. En programas de manejo integrado de plagas y enfermedades, los compuestos de H. longipes pueden disminuir la densidad de inóculo del hongo impidiendo el desarrollo de la enfermedad. El presente reporte es el primero que muestra la efectividad del EC y la mezcla A/DB, para controlar la incidencia de la antracnosis del frijol en invernadero y campo.
CONCLUSIONES
El EC y la mezcla de compuestos purificados A/DB, reducen la incidencia de la antracnosis del frijol en invernadero y campo al mismo nivel que el fungicida regional evaluado. Las plantas sometidas a la aplicación de los tratamientos no mostraron síntomas de fitotoxicidad, lo que se confirmó en el peso seco de las plantas tratadas. La aplicación de estos compuestos en campo no tuvo efecto sobre la colonización de las raíces de frijol por HMVA y la nodulación por bacterias fijadoras de nitrógeno.
AGRADECIMIENTOS
Los autores agradecen a la Coordinación de la Investigación Científica de la UMSNH por el apoyo financiero otorgado al proyecto 2.10–RSG/CIC–UMSNH, P.D.L.L., recibió beca del CONACYT y la UMSNH.
LITERATURA CITADA
Amadioha, A. C. 2000. Controlling rice blast in vitro and in vivo with extracts of Azadirachta indica. Crop Protection 19: 287–290. [ Links ]
Badii M., H., A. Flores E., R. Foroughbakhch, H. Quiroz, y R. Torres. 1996. Ecología del Manejo Integrado de Plagas (MIP) con observaciones sobre control biológico de insectos. In: Avances recientes en la Biotecnología de Bacillus thuringiensis. Universidad Autónoma de Nuevo León, Monterrey, México, pp: 40–47. [ Links ]
Cox, C. 2006. Ten reasons not to use pesticides. J. Pest. Reform. 26: 10–12. [ Links ]
Ferrera C., R., C. González CH., y J. Pérez M. 1998. Biotecnología de la micorriza arbuscular en fruticultura. Colegio de Postgraduados, Montecillo, Edo. de México. pp: 62–66. [ Links ]
Fisher, T. R. 1957. Taxonomy of the genus Heliopsis (Compositae). Ohio J. Sci. 57: 171–191. [ Links ]
Goes, A., R. B. O. Garrido, R. F. Reis, R. B. Baldassari, and M. A. Soares. 2008. Evaluation of fungicide applications to sweet orange at different flowering stages for control of postbloom fruit drop caused by Colletotrichum acutatum. Crop Protection 27: 71–76. [ Links ]
González, M., R. Rodríguez, M. E. Zavala, J. L. Jacobo, F. Hernández, J. Acosta, O. Martínez, and J. Simpson. 1998. Characterization of Mexican isolates of Colletotrichum lindemuthianum by using differential cultivars and molecular markers. Phytopathology 88: 292–299. [ Links ]
Gullino, M .L., P. Leroux, and C. M. Smith. 2000. Uses and challenges of novel compounds for plant disease control. Crop Protection 19: 1–11. [ Links ]
Hidalgo R., y C. M. Araya. 1993. Estado de crecimiento óptimo del frijol común para el combate químico de antracnosis (Colletotrichum lindemuthianum) y mancha angular (Isariopsis griseola) en San Carlos, Costa Rica. Agronomía Costarricense 17: 75–80. [ Links ]
Key, K. M., C. G. Ja, and L. H. Seon. 2003. Fungicidal property of Curcuma longa L. rhizome–derived curcumin against phytopatogenic fungi in a greenhouse. J. Agric. Food. Chem. 51: 1578–1581. [ Links ]
Lee, S. E., J. E. Kim, and H. S. Lee. 2001. Insecticide resistance in increasing interest. Agric. Chem. Biotechnol. 44: 105–112. [ Links ]
Martínez, M. 1994. Las Plantas Medicinales de México. Botas (eds). 6ª edición. México. pp: 113–115. [ Links ]
Mendoza–Zamora, C. 1991. Diagnóstico de enfermedades fungosas. Boletín. Departamento de Parasitología Agrícola. Universidad Autónoma Chapingo. Chapingo, México. pp: 15–76. [ Links ]
Molina–Torres, J., R. Salgado–Garciglia, E. Ramírez– Chávez, and R. E. Del–Río. 1995. Presence of the bornyl ester of deca–2E, 6Z, 8E–trienoic acid in Heliopsis longipes roots. J. Nat. Prod. 58: 1590–1591. [ Links ]
Molina–Torres, J., R. Salgado–Garciglia, E. Ramírez– Chávez, and R. E. Del–Río. 1996. Purely olefinic alkamides in Heliopsis longipes and Acmella (Spilanthes) oppositifolia. Biochem. Syst. Ecol. 24: 43–47. [ Links ]
Okigbo, R. N., and U. O. Ogbonnaya. 2006. Antifungal effects of two tropical plant leaf extracts (Ocimum grattisimum and Aframomum melegueta) on postharvest yam (Dioscorea spp.) rot. African J. Biotechnol. 5: 727–731. [ Links ]
Pastor, C. M., M. Otoya, A. Molina, and S. Singh. 1995. Resistance to Colletotrichum lindemuthianum isolates from Middle America and Andean South America in different common bean races. Plant Dis. 79: 63–67. [ Links ]
Phillips, J. M., and D. S. Hayman. 1970. Improved procedures for cleaning roots and staining parasitic and vesicular arbuscular mycorrizal fungi for rapid assessment of infection. Trans. Br. Mycol. Soc. 55: 158–161. [ Links ]
Ramírez– Chávez, E., L. Lucas–Valdez, G. Virgen–Calleros, y J. Molina–Torres. 2000. Actividad fungicida de la afinina y del extracto crudo de raíces de Heliopsis longipes en dos especies de Sclerotium. Agrociencia 34: 207–215. [ Links ]
Samaniego–Russo, R., A. Larqué–Saavedra, y R. Ferrera–Cerrato. 1996. El transplante de frijol inoculado con Rhizobium como estrategia para incrementar la fijación biológica de nitrógeno en condiciones de secano. Agrociencia 30: 345–351. [ Links ]
Schoonhoven A., y M. Pastor A. 1987. Sistema estándar para la evaluación de germoplasma de frijol. Centro Internacional de Agricultura Tropical (CIAT). Cali, Colombia. 56 p. [ Links ]
Silva–Flores, M. A., J. C. Rodríguez–Maciel, O. Díaz–Gómez, y N. Bautista–Martínez. 2005. Efectividad biológica de un derivado de ácido graso para el control de Macrosiphum rosae L. (HOMOPTERA: APHIDIDAE) y Tetranychus urticae Koch (ACARI: TETRANICHYDAE). Agrociencia 39: 319–325. [ Links ]
Steel R., G., y J. Torrie H. 1980. Bioestadística: Principios y Procedimientos. McGraw–Hill (eds.). 2ª Edición. pp: 226–227. [ Links ]
5 Covián, N.F. 1999. Evaluación del efecto del extracto de chilcuague (Heliopsis longipes) sobre el crecimiento de hongos fitopatógenos. Tesis de Maestría en Ciencias. Instituto de Investigaciones Químico Biológicas. Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Michoacán, México. 62 p.